Cas clinique – Embolie pulmonaire et cancer
Jean, 71 ans, à la retraite, se présente au service des urgences pour une dyspnée associée à de la confusion. Ses antécédents incluent une hypertension artérielle, une bronchopneumopathie chronique obstructive (BPCO) post-tabagique, un cancer épidermoïde pulmonaire du lobe inférieur droit, traité par chirurgie et chimiothérapie en 2015 et considéré en rémission, ainsi qu’une infection à COVID-19 sans aucun symptôme persistant.
Actuellement, Jean est traité par un bronchodilatateur de longue durée d’action, un β2 agoniste de courte durée d’action, un β-bloquant et un inhibiteur de l’enzyme de conversion.
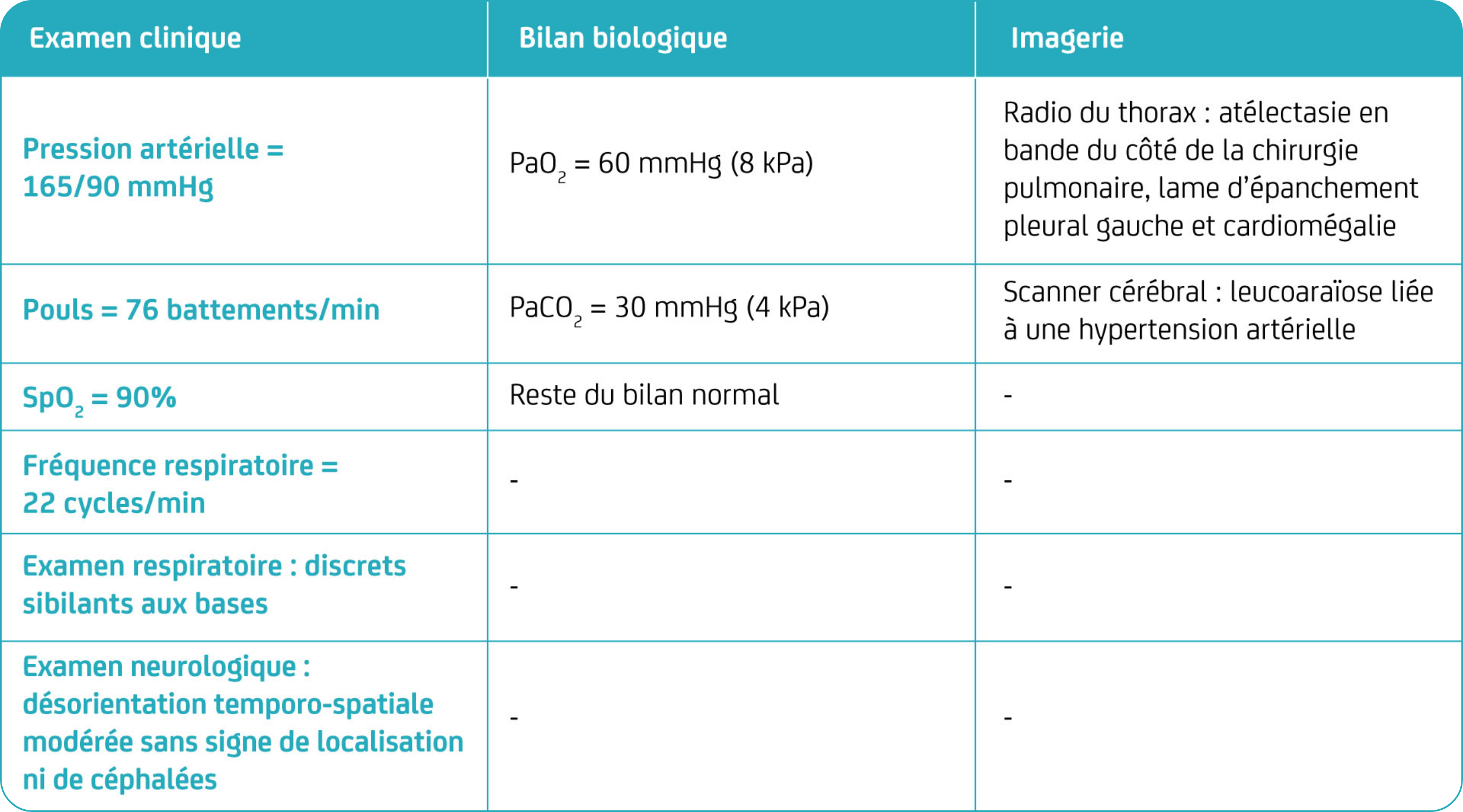
PaO2 : pression partielle artérielle en O2 ; PaCO2 : pression partielle artérielle en CO2 ; SpO2 : saturation pulsée en O2.
Une embolie pulmonaire (EP) est suspectée.
Le tableau clinique de l’EP est-il identique chez le sujet âgé ?
Non, la présentation clinique de l’EP est moins discriminante chez le sujet âgé.(1) Les symptômes de l’EP les plus fréquemment retrouvés sont la dyspnée, la tachycardie, la tachypnée et la douleur thoracique.(1) Ces symptômes sont peu spécifiques et communs avec d’autres maladies cardio-respiratoires comme l’insuffisance cardiaque, la pneumonie ou l’exacerbation d’une BPCO qui sont fréquemment retrouvées dans cette population et qui compliquent donc le diagnostic de l’EP.(1-3)
Comment confirmer la suspicion d’EP ?
Pour orienter la stratégie diagnostique, il convient d’évaluer la probabilité clinique d’EP du patient en utilisant un score clinique validé, comme le score révisé de Genève ou le score de Wells, ou en se basant sur le jugement implicite du clinicien.(4) Dans le cas de Jean, la probabilité clinique d’EP est de niveau intermédiaire en utilisant le score de Genève révisé (validation des items “âge > 65 ans” et “fréquence cardiaque entre 75 et 94 battements/min”).(4) Lorsque la probabilité clinique est faible ou intermédiaire, la Société de pneumologie de langue française (SPLF) recommande de réaliser un dosage des D-dimères pour exclure le diagnostic d’EP, sans réalisation d’examens d’imagerie si le résultat est négatif (grade 1+).(4)
Chez les patients âgés de plus de 50 ans, il est suggéré d’utiliser une valeur seuil des D-dimères adaptée à l’âge (grade 2+).(4)
Le scanner confirme une EP des deux lobes inférieurs avec infarctus à droite et épanchement à gauche. Comment évaluer la gravité de l’EP de Jean ?
Plusieurs scores cliniques prédictifs de la gravité de l’EP ont été développés incluant le score pronostique de Genève, le score Pulmonary embolism severity index (PESI) original ou simplifié et le score PREP, voir Tableau 1.(5) En stratifiant le risque de mortalité précoce du patient, ces scores permettent d’orienter vers la stratégie thérapeutique la plus adéquate.(4,5) Pour identifier les patients éligibles à un traitement ambulatoire, la règle HESTIA, le score PESI original, ou encore le score PESI simplifié, peuvent être utilisés, en association avec les critères pragmatiques (grade 2+).(4)
Tableau 1 : Scores PESI original et simplifié(4)
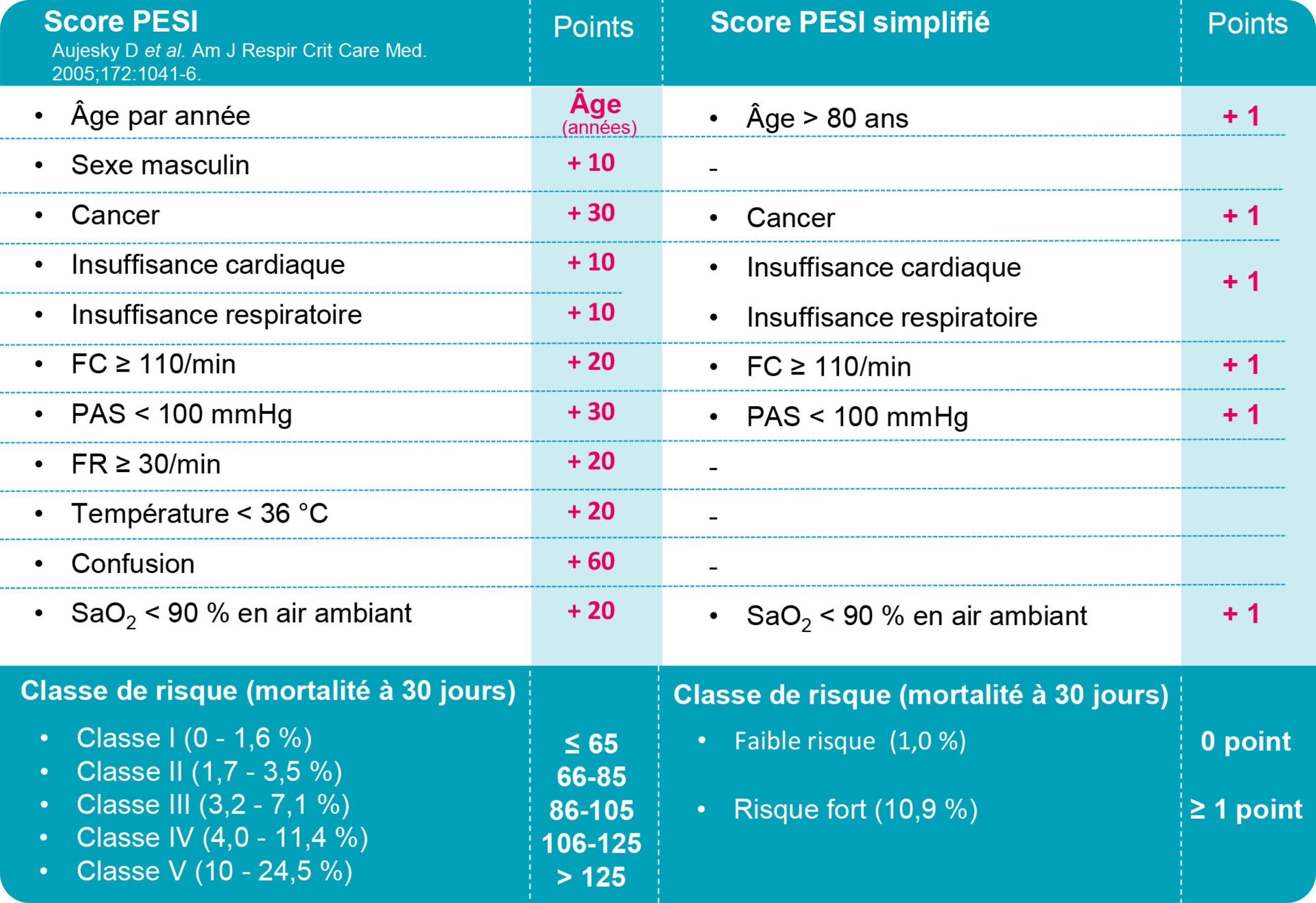
FC : fréquence cardiaque ; FR : fréquence respiratoire ; PAS : pression artérielle systolique ; PESI : pulmonary embolism severity index ; SaO2 : saturation artérielle en oxygène.
Le score PESI de Jean est de 121, les marqueurs biologiques et d’imagerie sont négatifs. Quel est le traitement d’une EP à risque intermédiaire-faible ?
Deux stratégies thérapeutiques sont envisageables : un traitement par anticoagulant injectable d’au moins 5 jours suivi d’un relais par un antivitamine K ou un traitement par anticoagulant oral direct (AOD).(4) Dans tous les cas, avant d’initier le traitement anticoagulant de Jean, il est recommandé d’évaluer ses fonctions rénale (grade 1+ pour un anticoagulant injectable) et hépatique et si le traitement choisi est un AOD, de doser son hémoglobine.(4,6)
Lors du bilan étiologique, l’examen biologique du patient révèle une hyperlymphocytose à 6000/mm3. Le reste du bilan hématologique est normal. Sur le scanner, vous constatez que le site implantable posé pour la chimiothérapie en 2015 est toujours présent. Que prévoyez-vous ?
Le premier examen diagnostique à réaliser est une radiographie thoracique pour rechercher une éventuelle malposition du cathéter veineux central qui prédisposerait à une thrombose et pour analyser l’intégrité et la morphologie du cathéter et de la chambre implantable.(7) Une opacification du cathéter permettra de distinguer différentes étiologies comme une gaine de fibrine ou un thrombus de l’extrémité distale du cathéter.(7) Lors d’une suspicion de thrombose, un échodoppler utilisant la compression (grade 1+) ou un angioscanner est également suggéré afin de confirmer le diagnostic de thrombose veineuse profonde des membres supérieurs.(4,7)
Concernant la stratégie thérapeutique, à ce jour, aucune étude clinique n’a été réalisée pour évaluer les anticoagulants dans le traitement de la thrombose du cathéter chez les patients avec cancer.(8) Que le cathéter veineux soit retiré ou non, les recommandations de la SPLF suggèrent de traiter les thromboses veineuses profondes symptomatiques sur cathéter veineux central pendant au moins 3 mois (grade 2+).(4)
Références :
1. Le Gal G et al. Differential value of risk factors and clinical signs for diagnosing pulmonary embolism according to age. J Thromb Haemost. 2005;3(11):2457-64.
2. Masotti L et al. Pulmonary embolism in the elderly: a review on clinical, instrumental and laboratory presentation. Vasc Health Risk Manag. 2008;4(3):629-36.
3. Konstantinides SV et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603.
4. Sanchez O et al. Recommandations de bonne pratique pour la prise en charge de la maladie veineuse thromboembolique chez l’adulte. Version courte. Rev Mal Respir 2019;36(2):249-83.
5. Bounameaux H et al. Embolie pulmonaire : place des scores diagnostiques et pronostiques. Rev Med Suisse. 2010;6:282-6.
6. ANSM. Les anticoagulants en France en 2014 : état des lieux, synthèse et surveillance. Avril 2014.
7. Madico C et al. Revue iconographique des aspects normaux et pathologiques des cathéters à chambre implantable. Journal d'imagerie diagnostique et interventionnelle 2018;1:47-59
8. Mahé I et al. Traitement de la maladie veineuse thromboembolique au cours du cancer. Mise à jour mars 2021. Rev Mal Respir. 2021. Doi : 10.1016/j.rmr.2021.03.001
Réf PP-UNP-FRA-1827 - CV-FR-2300203-NP - Septembre 2023

